重医柳满然教授团队在国际知名期刊《Journal of Extracellular Vesicle》发表最新研究成果

重庆医科大学
2021-10-01 18:55:08 文/赵阳 图/梁勇

9月20日,我校检验医学院/临床检验诊断学教育部重点实验室柳满然教授团队在国际知名期刊《Journal of Extracellular Vesicle》发表了题为“Hypoxia-stimulated ATM Activation Regulates Autophagy-associated Exosomes Release from Cancer-Associated Fibroblasts to Promote Cancer Cell Invasion”的论文,揭示低氧条件下癌相关基质成纤维细胞(CAFs)通过调控自噬与外泌泡形成,协调外泌体释放,促进癌细胞侵袭转移的新机制。

肿瘤是由癌细胞、微环境基质细胞、浸润到微环境的免疫类细胞、肿瘤血管、细胞外基质以及各种分泌成分和代谢产物等共同构成的复杂体系。近十余年来,柳满然教授带领团队在乳腺肿瘤微环境CAFs生物特性、CAFs对癌细胞侵袭转移、药物耐受等方面进行了较广泛、深入的研究。课题组既往研究揭示了乳腺肿瘤CAFs独特的基因表达谱与非编码RNA的特征,CAFs活化与活性维持,CAFs通过GPER-PI3K-CYP19A1引起的乳腺组织雌激素异常,CAFs对微环境ECM重塑,VEGF非依赖的肿瘤血管形成,CAFs与癌细胞间的代谢共栖等新型互作模式,较系统地阐明了CAFs对癌细胞转移复发、多种药物(如他莫昔芬、赫赛汀、表柔比星等)耐受中发挥着关键作用。近年来先后在《Cell Death Differentiatio》《Theranostics》等国际期刊发表了近20篇SCI论文。
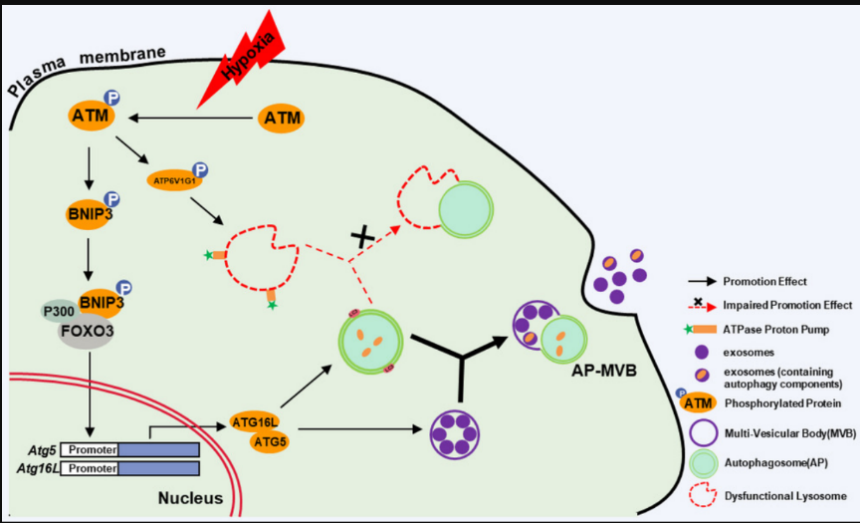
在新发表的这项研究中,研究者发现来源于未经放化疗及药物处理的乳腺肿瘤组织原代CAFs中存在异常活化的ATM,有别于经典的ATM,其主要分布于细胞浆中,我们称之为氧化型ATM(Oxidized ATM)。研究者们多手段多角度揭示了氧化型ATM、 细胞自噬与外泌体释放、肿瘤转移的内在联系;发现体内低氧环境下,CAFs中的氧化型ATM通过磷酸化BNIP3募集P300和FOXO3,转录调控与autophagosomes(APs)和exosomes囊泡形成相关的Atg5和Atg16L的表达,从而促进APs和分泌胞的形成;另一方面,氧化型ATM磷酸化溶酶体膜上与氢离子(H+)交换相关的ATP6V1G1,导致溶酶体对H+的吸取功能障碍,降低溶酶体对APs内吞或结合能力,从而使得APs和multi-vesicular bodies (MVBs)发生融合并促进外泌体的释放。此外,自噬相关的GPR64被包裹到外泌体内,并随之释放到肿瘤微环境中。乳腺癌细胞摄入富含GPR64的外泌体,激活非经典NF-κB 信号通路,上调MMP9 和 IL-8等与肿瘤侵袭转移密切的相关蛋白表达,使得癌细胞获得增强的侵袭转移能力。总之,该研究为肿瘤微环境CAFs促肿瘤进展提供了新的见解,揭示了氧化型ATM在调节自噬和外泌体释放方面的新功能。
我校检验医学院研究生席磊、彭美茜、刘水清、刘永灿、万雪颖为论文共同第一作者,柳满然教授为通讯作者。该研究持续近7年,得到了海外学者崔晓江教授和腾勇教授的大力协助。同时获得科技部国家重点计划项目、国家自然科学基金、重庆市高校创新研究群体项目等7项基金的资助,还得到校研究生院杰出研究生基金的支持。
来源:科研处 检验医学院
排版:黄泳琪
往期热点
医路征途,启航!
承继历史、再谱新篇!复旦重医全面合作协议签署
2021重医军训特辑丨九月正午的阳光都没你耀眼
你一票,我一票!“偶像老师”PK进行时!快来为重医的刘煜亮老师打CALL加油!
月满中秋 情暖校园丨重庆医科大学祝大家中秋快乐!
重医新生军训特辑丨除了站军姿、走正步,他们的军训还有——
点一下在看会变得更好看哦

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)





